
18 de abril de 2020
Município de Pombal cancela eventos culturais até 30 de junho

à(s)16:49 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
CTCV produziu e entregou viseiras ao Hospital Distrital da Figueira da Foz e Bombeiros Voluntários de Coimbra

à(s)14:53 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
COVID-19: Cientistas da UC avaliam as consequências da pandemia na família e na comunidade, em Portugal e no mundo

à(s)14:50 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
Montemor-o-Velho | Tablets e routers/hotspots 4g promovem igualdade para alunos do concelho

à(s)14:46 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
Município da Figueira da Foz promove aulas de exercício físico online

à(s)14:44 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
Município de Pombal doa refeições aos bombeiros durante a pandemia de COVID-19

à(s)14:38 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
DNM&Associados oferece viseiras ao Município de Pombal

à(s)14:37 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
15 de abril de 2020
18.091 casos em Portugal e 14 na Figueira da Foz (COVID-19)
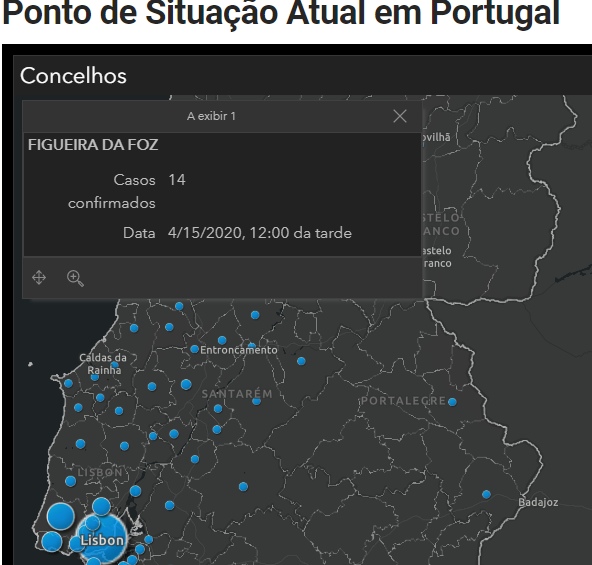
à(s)15:57 Sem comentários: Hiperligações para esta mensagem 
Enviar a mensagem por emailDê a sua opinião!Partilhar no TwitterPartilhar no FacebookPartilhar no Pinterest
Subscrever: Mensagens (Atom)
Mais recentes em destaque
-
-
Foto Ilustrativa
-
Foto ilustrativa do voluntariado na Figueira da Foz de Bonae Spei (Facebook) “Os jovens que Ataíde não quis na Piscina-Mar!” C...
-
Fotografia de Mercedes Benz A 4.ª edição das Buondi Surf Sessions vai passar por nove praias portuguesas e desafiar toda a gente...
-
INCÊNDIOS QUIAIOS Um incêndio florestal deflagrou esta tarde, por volta das 14h30, na freguesia de Quiaios. Segundo a Autoridade Nac...
-
-
CIDADE A multinacional sueca IKEA segundo a imprensa regional da região centro, poderá estar interessada em instalar-se na Figueira...
-
-
O Aquafun foi inaugurado hoje (dia 15 de Junho), na Praia do Cabedelinho, num dia que marca também o arranque da época balnear na fre...
-
Direitos de Autor
Todo o conteúdo deste site encontra-se protegido por direitos de autor. Não é autorizada a cópia permanente, no todo ou parte, e por qualquer forma, do conteúdo deste site, nem a colocação de links para este site em outros sites, sem o consentimento prévio escrito da Foz ao Minuto.
O utilizador não está autorizado a transmitir, distribuir, publicar, modificar, vender ou utilizar por qualquer forma a informação, incluindo imagens, contida neste site.
A prática de plágio é considerada crime, segundo a lei portuguesa.
A Foz ao Minuto encontra-se registada na Entidade Reguladora para a Comunicação Social (ERC) com o número de registo 126961, e encontra-se apta para as suas funções.
Caixa De Pesquisa
O nosso parceiro
O nosso parceiro Match Center Portugal oferece as melhores apostas online em Portugal
Principais destaques da semana
-
-
Foto Ilustrativa
-
Foto ilustrativa do voluntariado na Figueira da Foz de Bonae Spei (Facebook) “Os jovens que Ataíde não quis na Piscina-Mar!” C...
-
Fotografia de Mercedes Benz A 4.ª edição das Buondi Surf Sessions vai passar por nove praias portuguesas e desafiar toda a gente...
-
INCÊNDIOS QUIAIOS Um incêndio florestal deflagrou esta tarde, por volta das 14h30, na freguesia de Quiaios. Segundo a Autoridade Nac...
-
-
CIDADE A multinacional sueca IKEA segundo a imprensa regional da região centro, poderá estar interessada em instalar-se na Figueira...
-
-
O Aquafun foi inaugurado hoje (dia 15 de Junho), na Praia do Cabedelinho, num dia que marca também o arranque da época balnear na fre...
-
Notícias mais lidas de sempre
-
FIGUEIRA DA FOZ Segundo um estudo feito pela revista Vortexmag , a Figueira da Foz é a 12.ª cidade portuguesa com melhor qualid...
-
Fotografia de Mercedes Benz A 4.ª edição das Buondi Surf Sessions vai passar por nove praias portuguesas e desafiar toda a gente...
-
Foto ilustrativa do voluntariado na Figueira da Foz de Bonae Spei (Facebook) “Os jovens que Ataíde não quis na Piscina-Mar!” C...
-
INCÊNDIOS QUIAIOS Um incêndio florestal deflagrou esta tarde, por volta das 14h30, na freguesia de Quiaios. Segundo a Autoridade Nac...
-
CIDADE A multinacional sueca IKEA segundo a imprensa regional da região centro, poderá estar interessada em instalar-se na Figueira...
-
O Aquafun foi inaugurado hoje (dia 15 de Junho), na Praia do Cabedelinho, num dia que marca também o arranque da época balnear na fre...
-
De acordo com registos do IPMA (via SIC Notícias) , na Figueira da Foz as rajadas atingiram os 176 km/hora. A passagem do furac...
-
Fotografia cedida por um familiar de Orlando Fonseca NAUFRÁGIO A família de Orlando Fonseca, mestre da embarcação de pesca...
-
TRAGÉDIA Um homem de 33 anos perdeu a vida, alegadamente após afogamento, na Praia do Cabedelo (situada na freguesia de São P...
-



